Enfermedades Neuromusculares
Grupo Peruano multidisciplinario constituido por diversos especialistas con orientación al diagnóstico temprano y al manejo integral de los trastornos neuromusculares.
sábado, 31 de mayo de 2014
DIAGNOSTICO Y MANEJO DE LA ENFERMEDAD DE DUCHENNE-Parte 2
domingo, 30 de marzo de 2014
DIAGNOSTICO Y MANEJO DE LA ENFERMEDAD DE DUCHENNE-Parte 1
miércoles, 5 de febrero de 2014
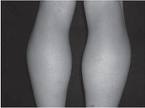
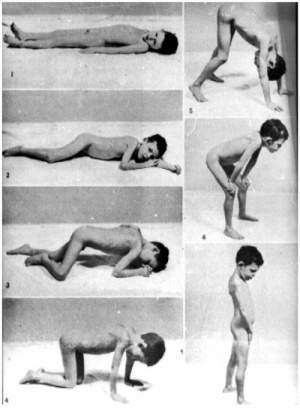
DISTROFIA MUSCULAR DE DUCHENNE
Anormalidades electrocardiográficas se pueden encontrar desde el comienzo de la enfermedad. Las cardiomiopatías y la insuficiencia cardíaca congestiva (ICC) son complicaciones frecuentes que se presentan durante la tercera década de la vida.
2. Erazo-Torricelli R. “Actualización en distrofias musculares”. [Rev Neuro. 2004; 39: 860-71]
Disponible en: http://www.neurologia.com/pdf/Web/3909/r090860.pdf
Adaptado por: Dr. Carlos Arce – Médico Fisiatra – Hospital Almenara (2014)
domingo, 26 de enero de 2014
TIPOS DE DISTROFIA MUSCULAR
Nota del editor: Duchenne muscular dystrophy (DMD). Becker muscular dystrophy (BMD)
|
| Tipo | Edad de aparición | Síntomas, índice de progresión y promedio de vida |
|---|---|---|
| Duchenne (Pesudohipertrófica) | Entre los 2 y los 6 años | Los síntomas incluyen debilidad y atrofia general de los músculos; afecta a la pelvis, la parte superior de los brazos y las piernas y finalmente a todos los músculos voluntarios; la supervivencia más allá de los 20 años es poco frecuente. |
|
Becker
|
Adolescencia a la edad adulta temprana | Los síntomas son casi idénticos a los de Duchenne, pero menos graves; y progresa más lentamente; supervivencia hasta la mediana edad. |
| Emery-Dreifuss | Entre la niñez y la pubertad | Los síntomas incluyen debilidad y atrofia de los músculos de los hombros, la parte superior del brazo y la región pretibial; son frecuentes las deformidades articulares; la progresión es lenta; puede producirse la muerte súbita por problemas cardiacos. |
| Cintura escapulohumeral o pélvica | Entre el final de la niñez y la mediana edad | Los síntomas incluyen debilidad y atrofia, que afectan primero a la cintura escapular (hombros) y pélvica; la progresión es lenta; la muerte suele deberse a complicaciones cardiopulmonares. |
| Facioescapulohumeral (Dejerine-Landouzy) | Entre la niñez a los adultez temprana | Los síntomas incluyen debilidad de los músculos faciales y deformidad y cierto grado de atrofia de los hombros y la parte superior del brazo; la progresión es lenta, con periodos de deterioro rápido; el paciente puede vivir varias décadas después de su aparición. |
| Distal | Entre los 40 y los 60 años | Los síntomas incluyen debilidad y atrofia de los músculos de las manos, los antebrazos y la parte baja de las piernas; la progresión es lenta; pocas veces conduce a la incapacidad total. |
| Oculofaríngea | Entre los 40 y los 70 años | Los síntomas afectan a los músculos de los párpados y de la garganta causando debilidad de los músculos de la garganta que, con el tiempo, produce incapacidad de tragar y emaciación por falta de alimentos; la progresión es lenta. |
| Congénita | Al nacer | Los síntomas incluyen debilidad general de los músculos y posibles deformidades de las articulaciones; la enfermedad progresa lentamente; vida corta. |
| Miotónica | Entre los 20 y los 40 años | Los síntomas incluyen debilidad de todos los grupos musculares acompañada de retardo en la relajación de los músculos después de la contracción; afecta primero a la cara, los pies, las manos y el cuello; la progresión es lenta; pueden vivir hasta los 50 ó 60 años. |
Topografía de afectación muscular en los diversos tipos de Distrofias.

|
a) Distrofia muscular de Duchenne y Becker b) Distrofia de Emery-Dreifuss c) Distrofia de las cinturas d) Distrofia facio-escapulo-humeral e) Distrofia distal f ) Distrofia óculo-faringea |
Principales áreas de debilidad muscular en los diferentes tipos de Distrofias.
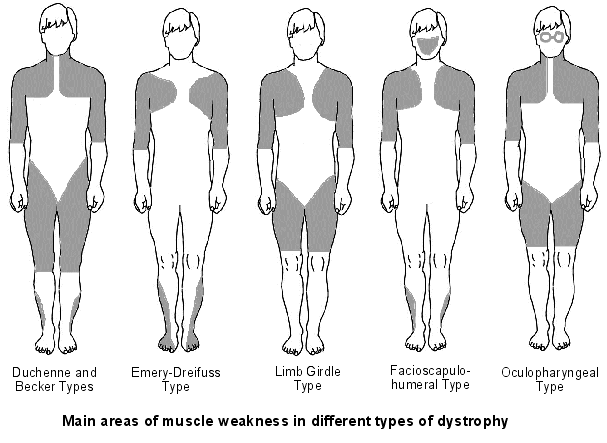
Traducido y adaptado de diversas fuentes (Arce C, 2014)
domingo, 19 de enero de 2014
DISTROFIA MUSCULAR DE DUCHENNE- Articulo de revisión
domingo, 5 de enero de 2014
MIOPATIAS INFLAMATORIAS IDIOPATICAS
Traducido y adaptado por: Dr. Carlos Arce – Médico Fisiatra – Hospital Almenara